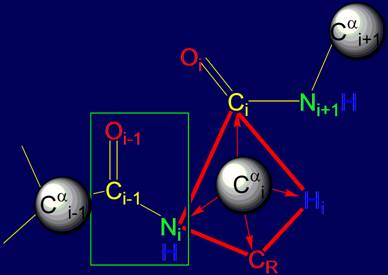
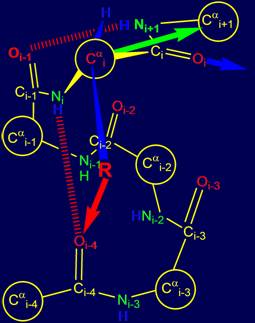
3.3. Тетраэдрический i-ый альфа-углеродный
атом
3.3.1. Анализ векторов тетраэдров, образуемых i-ым альфа-углеродным атомом
Связи атома
углерода Rai, к
которому прикрепляются боковые цепи канонического набора аминокислот в МВМ, как
и другие углеродные атомы, имеют тетраэдрическую структуру, т.е. все четыре
связи направлены в вершины тетраэдра. Как видно на рисунке 14,а в этих вершинах расположены атомы Ni, Нi, Сi,(группы
Oi=Ci–Ni+1H) и CR (углеродный атом боковой цепи).
Как показано на рис. 14,а и б, резонансная группа Oi-1=Ci-1–NiH является плоской
(заключена в прямоугольник) [ 15
], представляет собой единое целое и может
свободно вращаться. Через нее можно провести условную ось Cai-1 – Cai, на которой будет вращаться атом Cai(рис. 14,б).
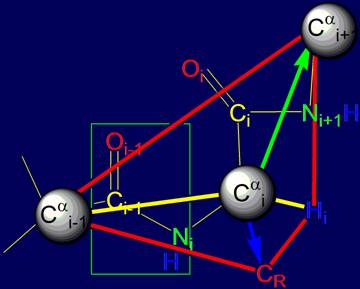
Поскольку все связи i-ого тетраэдрического атома углерода
жесткие, то вектора, направленные на i+1-ый атом основной цепи (Cai+1) и на атом СR боковой цепи будут жестко фиксированы и взаимосвязаны. На рис. 14,б они, соответственно, зеленого и
синего цвета. Это означает, что всякое
перемещение боковой цепи аминокислоты в процессе
воссоздания закодированной конформации белка будет
синхронно отражаться на направлении вектора Cai – Cai+1. За эту способность
эти два направления на i-ом альфа-углеродном атоме были названы «коромыслом».
Различные боковые цепи белка, связанные с
тетраэдрическим a-атомом, в рамках модели
МВМ будут предопределять различное
направление роста основной цепи. Рассмотрим этот вопрос более подробно.
|
|
|
|
Рис. 14. Сопоставление тетраэдров, сформированных на основе Cai: а –
валентными связями Сai , направленными в вершины тетраэдра; б – векторами,
направленными на Сai+1 (зеленая стрелка)
основной цепи и СR боковой цепи (синяя
стрелка). |
|
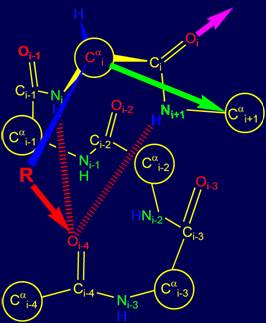
3.3.2. Возможные связи группы Oi=Ci–Ni+1Н с основной цепью
В зависимости от
возможной связи группы Oi=Ci–Ni+1Н с основной цепью можно
выделить четыре варианта направлений, два из которых показаны на рисунках 15,
а, б.
|
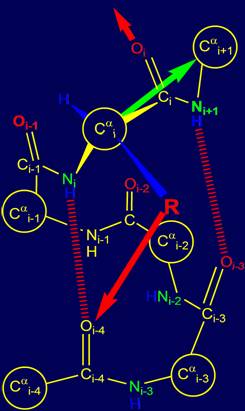
В том случае, если
боковая цепь (физический оператор) R задает направление,
при котором возможна водородная связь Ni+1Н с атомом Oi-3 (рис. 15,а), то альфа
спиральная конформация цепи [15] остается
неизменной (напомним, что предыдущая
водородная связь была NiН…Oi-4). Направление следующей
водородной связи для Oi показано красной
стрелкой. |
|
|
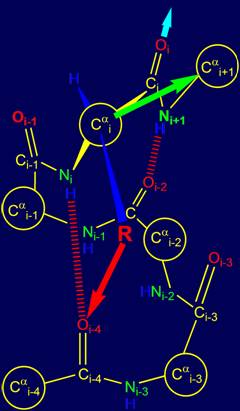
В случае, когда
физический оператор задает направление, допускающее образование водородной
связи группы Oi=Ci–Ni+1Н с атомом Oi-2 (рис. 15, б), то
спиральная структура становится более крутой, что соответствует в белках спирали 310 [ 15 ]. Направление следующей
водородной связи для Oi показано голубой стрелкой. |
|
Рис. 15. Варианты возможной водородной связи группы Oi=Ri–Ni+1Н: с атомом Oi-3(а) и с атомом Oi-2 (б). |
|||
Помимо спиральных
структур имеющиеся в каноническом наборе боковые цепи могут ориентировать
направление на Сai+1 углеродный атом с
образованием водородных связей с
атомами Oi-1 и на Oi
(рис.
16, а, б), что приводит к изгибам и крутым поворотам цепи.
|
Третий вариант связи,
который может быть задан физическими операторами из i-го положения, образован группой Oi=Ri–Ni+1Н с атомом Oi-1 (рис.16, а). Вполне вероятно, что
для реализации этого направления допустимо использование лишь нескольких
боковых цепей из канонического набора.
Направление следующей
возможной водородной связи для Oi-1 показано синей
стрелкой. |
|
|
Четвертым вариантом
водородной связи, показанным на рисунке 16, б, будет образование Н-связи в атомом Oi-4. Это соответствует ситуации, когда с этим атомом образуются одновременно две
водородных связи – NiH и Ni+1H группами,
принадлежащими к i-ому
и i+1-ому альфа-углеродным атомам. Такая ситуация,
разрешена только для аминокислоты глицина (Gly), не имеющего боковой цепи и обладающего конформационной
подвижность. Направление следующей
возможной водородной связи для Oi-1 показано розовой стрелкой. |
|
Рис.
16. Варианты возможной водородной связи группы Oi=Ri–Ni+1Н: с атомом Oi-1 (а) и с атомом Oi (б). |
|||
Таким образом, в
зависимости от длины боковой цепи, находящейся в i-ом положении, возможна детерминация последующего
направления роста полипептидной цепи. Отметим также, что подобная детерминация
зависит также и от структуры исходного пентафрагмента, находится ли он в альфа-спиральной конформации или какой-либо иной.
В связи «коромыслом»,
т.е. взаимосвязи двух направлений на i-том
альфа-углеродным атоме,
возникает проблема установления корреляции между размером боковой цепи и тем
направлением, которое она детерминирует.
Для решения этого вопроса могут быть использованы как математические
(например, геометрические), так и компьютерные подходы. Решение комплекса
проблем, возникающих в этой области, может сулить, как можно предположить,
получение важных результатов по прямому прогнозирования
вторичной структуры белка. Попытки в этом направлении предпринимались [ 6-8 ], но пока не привели к полному решению проблемы.
Теоретический анализ
области связи NiН…Oi-4 и сформулированные в
результате этого представления о
МВМ позволяют прояснить природу какнонического набора из 20 аминокислот как группы
неприводимых представлений векторов действия, которые можно выделить в этой
области.
Однако,
такой взгляд является несколько упрощенным. Как мы видели на страничке http://genetic-code.narod.ru, в основании генетического кода может
лежать 64 конформации 4х-звенного графа или пенафрагмента белка, из которых две или три конформации
связаны с кодированием начала или конца считывания (триплеты, кодирующие
стоп-сигналы). Остальные 61-62 конформации белка
должны воссоздаваться с помощью боковых цепей. Возникает вопрос: как увязать
факт существования лишь 20 аминокислот с возможностью кодирования триплетами
(хотя и сильно вырожденного) более чем 60-ти конформаций
белка. Этот вопрос принципиально
решается, если мы включим в рассмотрение не только сами боковые цепи, но и те
группировки, которые они несут. Учет этих группировок приводит к двухъярусной
модели МВМ, которая изложена в разделе
4
нашей странички.
Адрес для связи: vector-machine@narod.ru