3.2. Канонический набор аминокислот
На страничке http://amino-acids-20.narod.ru, посвященной пространственной
структуре канонического набора аминокислот, было сказано, что объяснение природы этого набора, а также принципов
расположения боковых цепей аминокислот на додекаэдре будет дано в модели МВМ.
Напомним эти принципы:
1.
Основа для построения – структура додекаэдра.
2.
Расположение боковых цепей на додекаэдре - в порядке возрастания
молекулярной массы.
3.
Боковые цепи аминокислот расположены на додекаэдре по отношению
друг к другу на основе принципов
антисимметрии .
Предлагаем
такое объяснение с использованием теоретико-группового подхода, примененного в разделе 3.1. для анализа
векторов действия.
Из определения
представлений группы [ 16 ] следует. Пусть имеется
некоторая конечная группа G с элементами g1, g2, …gn. Если группа T
линейных
операторов Tgi в некотором
пространстве R гомоморфна группе G, то говорят, что группа T
образует представление группы G. Из анализа свойств линейных операторов вытекает, что каждому
элементу gi группы можно сопоставить
матрицу || Drk(gi)||. При этом
нейтральному элементу должна быть сопоставлена нейтральная матрица, а обратному
элементу – обратная матрица.
По аналогии с элементами
группы и их представлениями, боковые цепи аминокислот, рассматриваемые нами в
качестве физических операторов, можно назвать «неприводимыми представлениями»
группы векторов. Определение «неприводимые» использовано нами в том смысле, что
эти боковые цепи являются самыми простыми и проще их не может быть. Используя
эту аналогию, мы сопоставим группы векторов и группы боковых цепей аминокислот
(физических операторов), воссоздающих действие этих векторов. Такое
сопоставление оказывается полезным с точки зрения развития представлений о
структуре, которую должен иметь
канонический набор боковых цепей.
3.2.1. Боковые
цепи аминокислот, реализующие действие нейтрального и обратного элементов
Проведем анализ некоторых
аминокислот как элементов группы неприводимых представлений. В этой группе,
исходя из аксиом математической группы, должны быть элементы, реализующие
действие нейтрального и обратного элементов.
Вектор, являющийся в
группе векторов нейтральным элементом, должен, очевидно, воссоздаваться
физическим оператором, который не будет влиять на структуру пентафрагмента
белка. Это означает, что такой оператор может вообще не иметь боковой цепи, а
являться «пустым» звеном в цепи белка. По своим свойствам он должен относится к
подгруппе операторов связности. Единственная аминокислота, которая подходит на
эту роль - это глицин (Gly),
который не имеет боковой цепи и в самом деле является «пустым» звеном в цепи
белка (структуру Gly и других аминокислот см. на сайте http://amino-acids-20.narod.ru/aminoacids.htm).
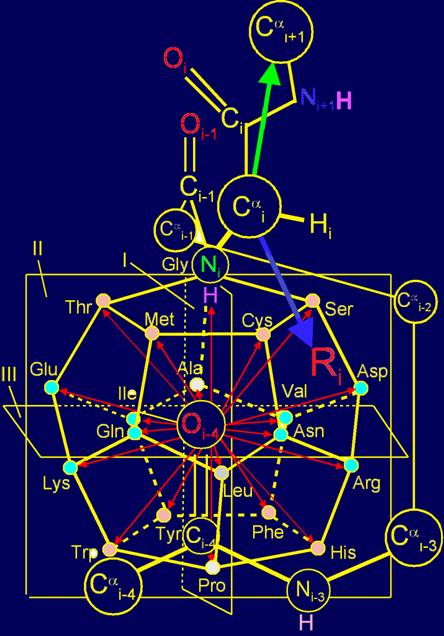
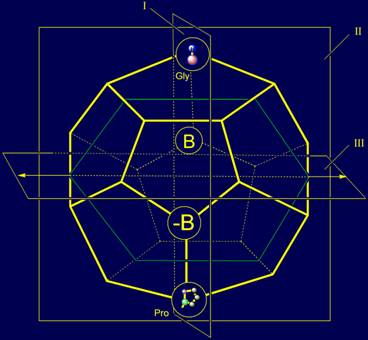
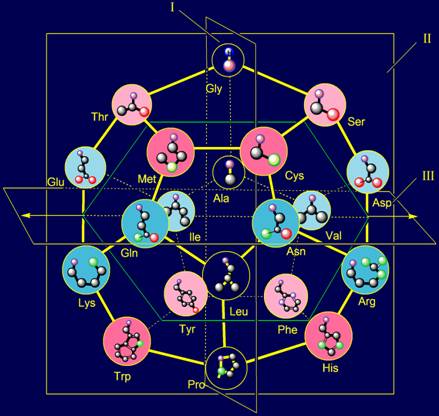
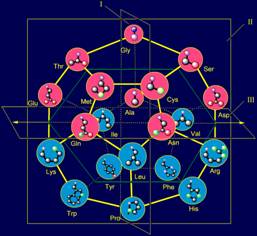
В модели структуры
канонического набора аминокислот на додекаэдра (рис. 11,б) Gly
расположен в плоскости I и занимает одну из верхних вершин. В МВМ (рис. 11,а) его атом
азота становится Ni атомом, связанным с Сai-атомом основной цепи.
Отсутствие боковой цепи у этой аминокислоты приводит к тому, что связь Ni H…Oi-4=C оказывается нерегулируемой.
Как известно, Gly обладает большой конформационной подвижностью [ 15 ], что способствует выполнению глицином функции нейтрального
элемента.
|
|
|
|
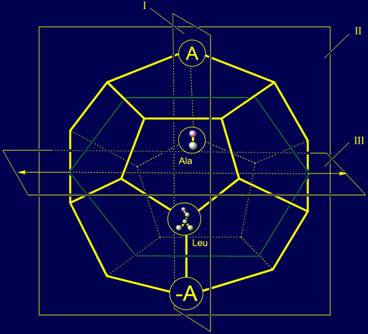
Рис. 11. Молекулярная векторная машина белков (а), и положение
аминокислот, реализующих действие нейтрального и обратного элементов (б),
направленных вдоль связи NiH…Oi-4=C, а также аминокислот, реализующих действие
векторов, направленных поперек этой связи (в) в модели на додекаэдре.. |
|
Вектор, соответствующий
обратному элементу группы, имеет противоположное по действию направление,
направленное на разрыв связи Ni H…Oi-4=C. Его может реализовать
такой физический оператор, у которого атом Ni в принципе не может образовать водородную связь с группой
Oi-4=C. Такая ситуация возможна, например, если атом Ni заключен в циклическую структуру. При этом атом Oi-4 может приобрести противоположное водородной связи направление в
результате «лобового» столкновения его электронной оболочки с электронной
оболочкой этой циклической неполярной структуры.
.
Наиболее подходящим на
роль обратного элемента боковой цепью является пролин (Pro). Взгляните на его
циклическую структуру: http://amino-acids-20.narod.ru/aminoacids.htm. Это единственная боковая цепь, атом азота
которой, образующий пептидную связи в основной цепи, заключен в цикл. Этот атом
в принципе не может образовать водородную связь с группой Oi-4=C с
образованием циклического пентафрагмента, циклическая же часть пролина может
участвовать в лобовом столкновении с этой группой и тем самым реализовать
действие вектора, направленного на разрыв Н-связи. На рисунке 10,б, в модели
структуры канонического набора аминокислот на додекаэдра пролин расположен
также в плоскости I , но занимает одну из нижних вершин.
Таким образом, в
каноническом наборе аминокислот имеются две боковых цепи - Gly и
Pro, способные выполнять роль, соответственно. нейтрального и
обратного элементов при рассмотрении их в качестве неприводимых представлений
векторов.
Кроме действия вдоль
связи NiH…Oi-4=C, в группе векторов имеется подгруппа, действие которой направлено
поперек этой связи. Они также расположены в плоскости I (см. рис. 11, а). На роль
представлений этих векторов подходят две аминокислоты - аланин (Ala) и лейцин (Leu).
Их положение в модели структуры канонического набора аминокислот на додекаэдре
показано на рисунке 11, в.
3.2.2. Расположение аминокислот в
порядке возрастания молекулярной массы
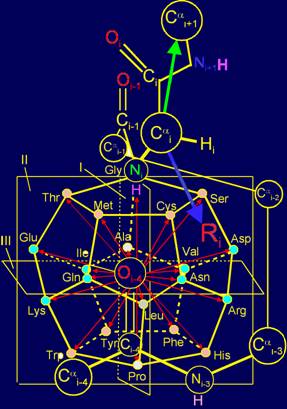
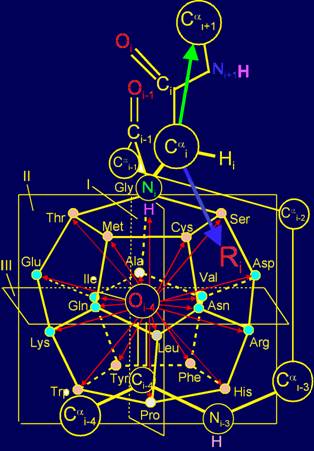
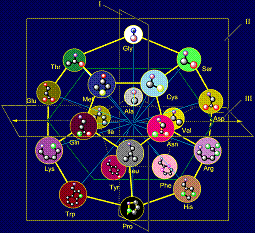
Как следует из рисунка
12,а, точкой приложения множества векторов (стрелки красного цвета) и множества
боковых цепей аминокислот (стрелка синего цвета), обозначаемых как Ri, являются вершины
додекаэдра. С одной стороны, это точки, в которые направлены вектора,
действующие на связь NiH…Oi-4=C, а с другой стороны, они являются местом приложения боковых
цепей аминокислот в роли физических операторов, реализующих действие этих
векторов.
Вектора в МВМ имеют
различное направление: Часть из них направлено в сторону атома Ni, а часть – в противоположную сторону.
Соответственно, боковые цепи аминокислот, воссоздающие вектора направленные в
сторону атома Ni, как это видно из рисунка 12,а, должны быть короче боковых
цепей, воссоздающих вектора, направленные в сторону Оi-4=С.
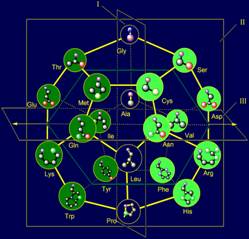
Боковые цепи аминокислот
в модели на додекаэдре (рис. 12,б) расположены в порядке увеличения их массы и,
соответственно, размера что обеспечило реализацию этого принципа в МВМ.
Более короткие боковые
цепи (Ser, Thr, Cys, Met – в розовых кружках), как
видно рисунке 12,б, расположены в верхней части додекаэдра и будут воссоздавать
вектора, направленные вдоль плоскости I в сторону атома Ni. Более массивные,
например, циклические (Phe, Tyr, His, Trp, также в розовых кружках) расположены в нижней части и будут
воссоздавать вектора, также направленные вдоль плоскости I, но
в противоположную сторону.
В центральной части
додекаэдра расположены боковые цепи, воссоздающие вектора, направленные вдоль
плоскости III – это боковые цепи среднего размера и массы (Asp, Asn, Arg, Glu, Gln, Lys –
в голубых кружках). Детали расположения боковых цепей на додекаэдре изложены на
сайте http://amino-acids-20.narod.ru/AA_dodecahedron.htm.
|
|
|
|
Рис. 12. Молекулярная векторная машина белков (а) и модель
структуры канонического набора аминокислот на додекаэдре (б). |
|
Таким образом, принцип расположения
боковых цепей аминокислот на додекаэдре в порядке увеличения размеров и
молекулярной массы обусловлен тем, что боковые цепи по мере увеличения размеров
обеспечивают реализацию действия всех направлений векторов, заданных структурой
додекаэдра.
3.2.3. Антисимметрия боковых цепей
Поскольку на модели структуры канонического набора
аминокислот имеется три плоскости
антисимметрии, то переход через эти плоскости к антисимметричной аминокислоте
можно обозначить какой-либо буквой. На страничке http://amino-acids-20.narod.ru/AA_antisymmetries.htm были введены
следующие обозначения:
- переход аминокислоты в
самою себя обозначен цифрой 1.
- переход через плоскость I – буквой a (альфа),
- переход через плоскость II – буквой b (бета);
- вращение вокруг оси, лежащей в плоскости III – буквой g (гамма). Тогда все преобразования
аминокислот, расположенных в столбце 1, внутри каждой группы можно
описать в виде следующей таблицы.
|
|
1 |
a |
b |
g |
ab |
ag |
bg |
abg |
|
Подгруппа
1 |
Gly |
|
|
Pro |
|
|
|
|
|
Подгруппа
2 |
Ala |
|
|
Leu |
|
|
|
|
|
Подгруппа
3 |
Ser |
Thr |
Cys |
His |
Met |
Trp |
Phe |
Tyr |
|
Подгруппа
4 |
Asp |
Glu |
Asn |
Arg |
Gln |
Lys |
Val |
Ile |
Эти антисимметричные
преобразования в принципе повторяют симметричные преобразования векторов,
которые воссоздают боковые цепи аминокислот (раздел 3.1.), только вместо симметрии для боковых цепей
аминокислот выступает антисимметрия.
На страничке http://amino-acids-20.narod.ru/AA_antisymmetries.htm показано, что структура
додекаэдра выявляет четыре типа антисимментрии, имеющейся у боковых цепей
аминокислот: квази-зеркальная, незеркальная, поворотная, и комплементарная. Использование подхода к боковым цепям как
неприводимым представлениям векторов в МВМ позволяет с единых позиций дать
объяснение природы этих типов антисимметрии.
|
Квази-зеркальная |
Незеркальная |
|||
|
Боковые цепи аминокислот, воссоздающие вектора, направленные
вправо от плоскости I, должны быть более
короткими. Положение Сai-атома, к которому прикрепляются боковые цепи аминокислот как
физические операторы МВМ белка, как видно на рисунке 13,а, несколько
асимметрично и сдвинуто вправо относительно связи NiH…Oi-4=C. Это означает, что боковые цепи, воссоздающие симметричные по
отношению к плоскости I вектора, направленные
вправо от этой плоскости, должны быть короче, чем боковые цепи, реализующие
действие векторов, направленных влево от этой плоскости. Данная
закономерность должна проявляться в отношении всех боковых цепей, что должно
приводить к формированию из них двух групп аминокислот, обладающих близкими
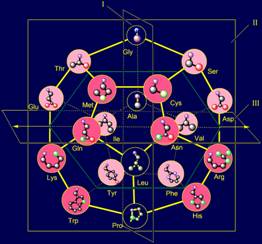
свойствами, но разной длиной. Именно поэтому канонический набор аминокислот
состоит из двух групп, которые удалось расположить на додекаэдре симметрично
относительно плоскости I (рис. 13, б). Это соответствует их квази-зеркальной
антисимметрии: (http://amino-acids-20.narod.ru/quasi_mirror_antisymmetry_AA.htm ). |
Близкие по размеру, но разные по свойствам боковые цепи должны
воссоздавать вектора, расположенные симметрично по отношению к плоскости II. Как видно на 13,а, расстояние от Сai-атома до вершин, в которые направлены
симметричные вектора, находящиеся за плоскостью II, (направлены от нас),
и перед плоскостью II (направлены к нам), различаются не очень сильно. По этой
причине боковые цепи, воссоздающие эти вектора, не должны существенно
различаться по размеру. Их различия могут состоять лишь в замене терминальных
групп. И действительно, пары аминокислот, расположенные в додекаэдре перед
плоскостью II и за ней, близки (рис. 13, в). Это соответствует их
расположению на основе незеркальной антисимметрии: (http://amino-acids-20.narod.ru/non_mirror_antisymmetry_AA.htm ). |
|||
|
|
||||
|
Рис. 13. Молекулярная векторная машина белков (а) и типы
антисимметрии, выявляемые с помощью модели структуры канонического набора
аминокислот на додекаэдре: квази-зеркальная (б), незеркальная (в), поворотная
(г) и комллементарная (д). |
||||
|
Поворотная |
Комплементарная |
|||
|
Более короткие боковые цепи аминокислот воссоздают вектора, расположенные над плоскостью III. Как видно на рисунке 13,а, вершины векторов, направленных в
сторону атома NiH, расположенные над плоскостью III, находятся значительно
ближе в Сai-атому, чем
симметричных им, но направленных в противоположную сторону, к атому Oi-4 (находится под плоскостью III). По этой причине все
вектора, находящиеся над плоскостью III,
должны воссоздаваться более короткими боковыми цепями аминокислот
(физическими операторами), чем
находящиеся под плоскостью III. Поскольку эти вектора связаны операцией
вращения вокруг оси С2 (g),
то аминокислоты с самыми короткими боковыми цепями должны противостоять самым
длинным. В то же время боковые цепи, воссоздающие вектора, расположенные в
экваториальной области додекаэдра
должны отличаться в меньшей степени, например, на одно звено в цепи.
Именно это мы наблюдаем в структуре канонического набора аминокислот на
додекаэдре (рис. 13, г). Это соответствует поворотной антисимметрии боковых цепей
аминокислот: (http://amino-acids-20.narod.ru/rotary_antisymmetry_AA.htm). Становится понятным, почему существует такая антисимметрия в
каноническом наборе боковых цепей аминокислот. |
Боковые цепи, воссоздающие вектора противоположного направления,
должны обладать дополнительными свойствами. Это связано с тем, что наклон оси этих
векторов один и тот же. Вместе оба вектора составляют его диаметр (см. рис.
13,а). При этом, поскольку диаметры соединяют вершины додекаэдра,
расположенные по разные стороны от плоскости I, то боковые цепи,
находящиеся на одной оси и расположенные справа от плоскости I
будут максимально приближены к Сai-атому, а расположенные слева от этой плоскости – максимально
удалены от Сai-атома. Это позволяет
понять, почему в структуре аминокислот (рис. 13,д) в вершинах додекаэдра,
соединенных диаметрами, находятся боковые цепи, свойства которых
дополнительны –антисимметрия комплементарности: http://amino-acids-20.narod.ru/AA_complementarity_antisymmetry.htm): Самая короткая цепь Ser связана с самой
массивной – Trp,
меньшая, по сравнению с Trp
цепь His связана с более
массивной, по сравнению с Ser, цепью Thr. Минимальная по
размеру отрицательно заряженная боковая цепь Asp находится на одном
диаметре с максимальной по длине положительно заряженной цепью Lys,
а более короткая цепь Arg связана с большей по длине Glu,
и т.д. Направление Сai – Сai+1, задаваемое каждой из
боковых цепей, воссоздающих вектора одинакового наклона, также должно быть,
по-видимому, одно и тоже. |
|||
Таким образом,
существование четырех типов антисимметрии, выявленных с помощью модели структуры
канонического набора аминокислот на додекаэдре, обусловлено участием боковых
цепей аминокислот в реализации в МВМ
симметричных векторов действия, имеющих различное направление.
Следующей составной
частью МВМ, которая рассматривается в разделе 3.3., является
тетраэдрический i-ый альфа-углеродный атом, служащий местом прикрепления сменяемых
боковых цепей аминокислот канонического набора.
Адрес для связи: vector-machine@narod.ru