|
|
МОЛЕКУЛЯРНАЯ
ВЕКТОРНАЯ МАШИНА БЕЛКОВ Персональная страница №3 |
|
Книга В.А.Карасева и В.В. Лучинина "Введение в конструирование бионических
наносистем"
Сайты В.А.Карасева: Принципы топологического
кодирования белков
New Пространственная
структура канонического набора аминокислот http://amino-acids-20.narod.ru В помощь атеисту: Новая теория,
объясняющая сущность и происхождение жизни |
Уважаемые
посетители! Благодарю,
что заглянули на мою страничку. Раньше
говорили: все дороги ведут в Рим.
Исследования, проводимые учеными, на первый взгляд, совершенно
независимые по направлениям, также иногда приводят в одну и ту же точку
пересечения. Предлагаемая
Вашему вниманию страничка является третьей по счету из задуманной автором
серии ВЕБ-страниц, посвященных проблеме топологического кодирования белков. Первая
страница http://genetic-code.narod.ru открывает эту серию и
носит общее название «Принципы топологического кодирования белков». Она
посвящена в основном структуре генетического кода и проблеме соответствия
триплет – аминокислота. Полученные в разделе 4.4. результаты (http://genetic-code.narod.ru/symm_conform.htm ) непосредственно
выводят на идею молекулярной векторной машины. На
второй странице http://amino-acids-20.narod.ru, которая называется
«Пространственная
структура канонического набора аминокислот», анализируется пространственная
структура канонического набора аминокислот, которая представлена в виде
додекаэдра. Попытка разобраться в том, почему возникла именно такая
структура, а не иная, также привела нас к идее молекулярной векторной
машины. Таким
образом, два независимых пути исследования привели нас к одной и той же идее молекулярной векторной
машины,
которой посвящена данная страница. Результаты
этой работы несколько опередили коллег, вследствие чего нам практически не на
кого сослаться, кроме как на собственные результаты [1-5], а также на попытки продолжить эти исследования в
оригинальном направлении двух независимых магистров [6-8]. Это, однако, не исключает, что в скором времени предлагаемый
путь исследований заинтересует коллег самых разных специальностей, в первую
очередь, физиков, математиков и молекулярных биологов и эти исследования будут продолжены. |
|
1.
Введение |
|
|
|
|
|
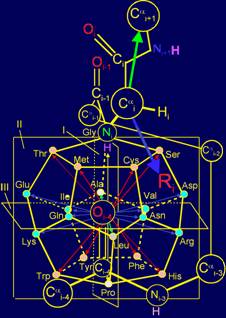
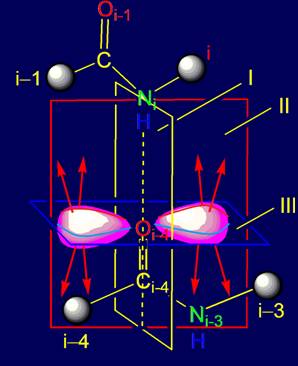
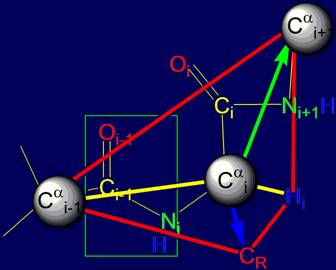
Объект анализа - область связи NiH….Oi-4=C в пентафрагменте
белка |
|
Во
введении определен объект предстоящего анализа – область
связи NiH….Oi-4=C в пентафрагменте
белка и намечены этапы ее рассмотрения
2. Этапы построения молекулярной векторной машины белков
|
|
|
|
Результаты:
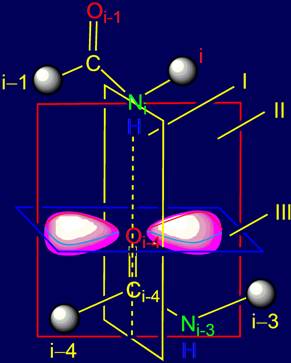
1.
В области связи NiH….Oi-4=C с позиции квантовой
химии введены три плоскости симметрии, разделяющие sp2-гибридизованные облака
на симметричные части.
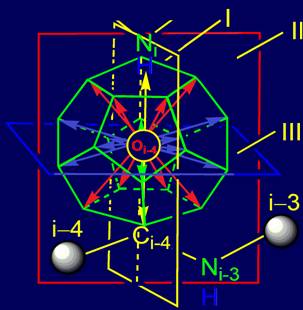
2.
С учетом выделенных плоскостей симметрии получено четыре группы
векторов действия.
3.
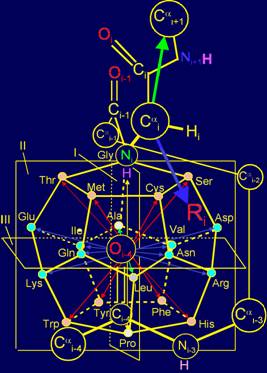
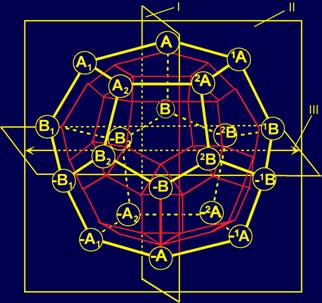
Предложена модель молекулярной векторной машины (МВМ), состоящая:
– из системы векторов, локализованных в структуре додекаэдра;
– канонического набора
боковых цепей аминокислот (сменяемых
физических операторов);
– тетраэдрического i-го альфа-углеродного
атома, к которому прикрепляются сменяемые боковые цепи аминокислот;
– пентафрагмента аминокислот основной цепи белка.
3.Свойства частей молекулярной векторной машины белков
|
|
|
Результаты:
1.
Проведен анализ векторов с позиции теоретико-группового подхода.
Сделан вывод, что 20 векторов внутри додекаэдра образуют математическую группу,
содержащую нейтральный и обратный элементы.
2.
На основе теоретико-группового подхода боковые цепи канонического
набора аминокислот рассматриваются как группа неприводимых представлений
векторов.
3.
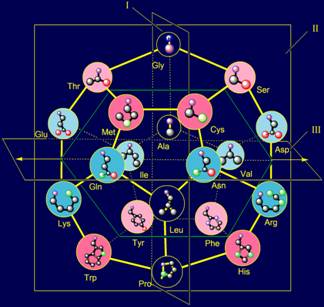
С позиции представлений о МВМ и теоретико-группового подхода
предложено объяснение принципов, использованных для построения пространственной
структуры канонического набора аминокислот на додекаэдре (http://amino-acids-20.narod.ru/AA_dodecahedron.htm):
- принципа расположения
боковых цепей сверху вниз в порядке увеличения размера;
- принципов антисимметрии боковых цепей аминокислот.
Сделан вывод, что эти принципы связаны с воссозданием ими
симметричных векторов действия в МВМ.
4.
Проведен анализ свойств тетраэдрического i-го альфа-углеродного
атома, являющегося своеобразным «коромыслом», задающим направление роста
полипептидной цепи в зависимости от типа боковой цепи, связанной с этим атомом.
5.
Предполагается, что анализ этой области может быть перспективным
для разработки методов прогнозирования вторичной структуры белков.
4. Двухъярусная модель
молекулярной векторной машины
Результаты:
1.
С целью разрешения противоречия между числом боковых цепей (20) и
количеством кодирующих триплетов (61) предложена двухъярусная модель
молекулярной векторной машины.
2.
Предполагается, что помимо додекаэдра, в качестве многогранника, занимающего
нижележащий уровень МВМ, может служить
ромбоикосододекаэдр.
5. Заключение. Практическое применение представлений о молекулярной
векторной машине
В представлениях о молекулярной векторной машине можно выделить
два аспекта. С одной стороны, они являются, как это часто бывает в науке,
формальной абстракцией (по типу тепловой машины Карно), удобной для описания и
объяснения ряда биологических фактов (например, природы канонического набора
аминокислот).
С другой стороны, эти
представления связаны с ко-трансляционным
механизмом формирования вторичной структуры белков [ 5 ], предполагающим, что процесс формирования вторичной структуры
белка происходит в рибосоме в момент его синтеза. По этой причине они вполне
пригодны в качестве конкретной машины, осуществляющей этот процесс в рибосоме.
Разумеется, этот механизм носит пока гипотетический характер, однако он может
быть ориентиром для специалистов, как теоретиков, так и экспериментаторов, и
служить отправной точкой для дальнейших исследований в разных направлениях.
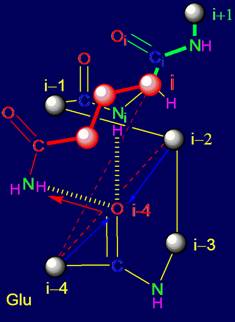
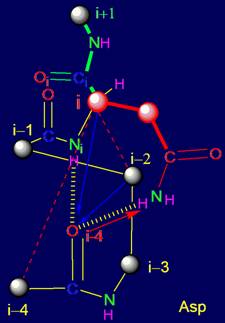
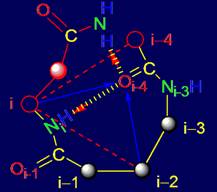
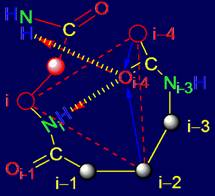
Кроме элементов, проанализированных в разделе 3, в структуру МВМ входят
также фрагменты из пяти аминокислот (пентафрагменты). В реальном белке
последовательность аминокислот и структура связей пентафрагментов является
фиксированным отражением результатов
работы МВМ. По этой причине, кроме
теоретического анализа свойств элементов МВМ, можно провести анализ
пентафрагментов белков, исследованных методом рентгеноструктурного анализа,
сохраняющих свои водородные связи в белке, в частности, во вторичной структуре.
Нами был проведен такой анализ.
Его детали, как мы полагаем, могут представлять достаточно
широкий интерес и в дальнейшем, по окончании всего цикла работ, мы предполагаем создать специальную страничку
для обоснования и изложения данного подхода.
В
ХОДЕ ПРОВЕДЕННОГО АНАЛИЗА БЫЛИ ПОЛУЧЕНЫ СЛЕДУЮЩИЕ РЕЗУЛЬТАТЫ:
- найдено 16 классов пентафрагментов, из которых 8 являются
основными и 8 – минорными.
- предложена пространственная структура для каждого класса,
изоморфная булевому гиперкубу B6.
- построена полная структура всех пентафрагментов, описываемая
булевым гиперкубом B4, в вершинах которого располагаются гиперкубы B6.
Для тех, кто хочет
ознакомиться с полученными результатами, сообщаем, что они опубликованы в
работах [ 9-11 ], доступны для чтения и
скачивания.
На основании этих результатов была создана БАЗА ДАННЫХ ПЕНТАФРАГМЕНТОВ
[ 12 ], и разработан способ прогнозирования
вторичной структуры белка [ 13 ], который также
доступен для ознакомления и скачивания. Данный способ можно осуществить как
вручную, так и с помощью компьютерной программы PREDICTOR [ 14 ]. Все эти материалы составляют единое целое и
могут служить предметом лицензионной продажи. С вопросами о приобретении
лицензии желающие могут обратиться к автору через эту страничку.
На белках, петафрагменты которых были использованы для создания
базы данных, точность предсказания вторичной структуры составляет 99%.
В настоящее время подана заявка на способ проектирования
первичной структуры белка с заданной вторичной структуры. Пока она находится на
стадии экспертизы.
Желаю Вам дальнейших научных впечатлений!
Адрес для связи: vector-machine@narod.ru
ã Работа
выполнялась в Центре микротехнологий и диагностики (ЦМИД) Санкт-Петербургского
государственного электротехнического университета "ЛЭТИ", при
финансовой поддержке университета.
Благодарность:
Выражаю искреннюю
благодарность Беляеву А.И. за помощь в редактировании английской версии этой
странички.